
專屬客服號

微信訂閱號
全面提升數據價值
賦能業務提質增效
來源: 動脈網 作者:郝瀚
過去的五年是中國創新藥蓬勃發展的五年,2018年藥審中心批準了9個國產1類創新藥,創歷史新高。近年來批準的國產創新藥中不乏代表性產品,如緊隨世界步伐的三款國產PD-1單抗,中國首發全球新藥羅沙司他,中國自主研發的First in Class藥物本維莫德等。這些都是國內創新藥企業不懈努力的關鍵成果。
除了創新藥行業自身的努力,政策加資本打造的中國創新藥新環境更是起到了關鍵性的輔助作用。從國家政策層面,國家機關連續發文,為創新藥產業發展打下政策基礎;從資本市場方面,港股和科創板的接連開放為國內的創新藥企業帶來了更多的資金來源;從國際接軌方面,中國加入ICH直接將中國的創新藥行業與國際串聯,將國產創新藥帶到了更大的舞臺上。
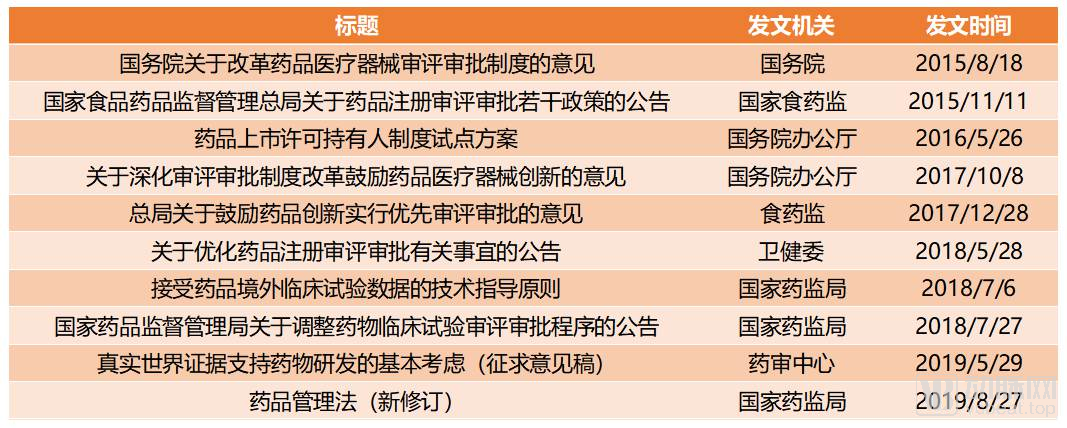
44號文以來國家有關促進創新藥發展的主要政策
2015年8月,國務院印發的國發〔2015〕44號《關于改革藥品醫療器械審評審批制度的意見》(以下簡稱44號文)正式拉開了國內創新藥監管改革的大幕。44號文之后,廳字〔2017〕42號《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(以下簡稱42號文)再一次對44號文中提到的內容進行了強調,尤其突出了“促進藥品創新和仿制藥發展”、“改革臨床試驗管理”、“加快上市審評審批”、“加強藥品醫療器械全生命周期管理”等幾個要點。
如今回頭看來,44號文和42號文在近幾年的創新藥相關政策中,起到了統領全局的作用。兩份文件中提到的幾大要點,都在經過幾年的驗證后,最終加入了2019年最新修訂的《藥品管理法》,成為正式的法律法規。
除了從概念上強調鼓勵創新藥行業發展之外,在近幾年的醫藥新政中,臨床審批加速、藥品審評審批加速和藥品上市許可持有人制度可以稱得上的相關部門用實際行動促進行業發展的三駕馬車。
1.臨床審批加速:從18個月到2個月
在默示許可制度出臺之前,從開始申報到最后拿到批件,臨床試驗審批一般要18個月左右。而這個時間,在澳大利亞是5天,美國、韓國是1個月,新加坡是1—2個月,歐盟是3個月,印度、俄羅斯是3—4個月。
更大的問題在于,這18個月的時間中,實際審批的時間大概就只有兩個月,其余時間都花在各種不必要的流程中。報藥審中心審批之前,先要報省局審核;報到藥審中心之后還要排隊,短則數月,長則一年;審評之后還不能直接上臨床,藥審中心的審評報告要轉到注冊司審查,注冊司審查之后批件還要轉到省局走內部程序,幾經周轉到了企業手上,又耽誤了幾個月時間。所以臨床試驗審批一直是我國創新藥企業長期以來心頭的痛。
44號文發布后,CFDA(現NMPA)積極響應,并迅速在2015年底出臺了《國家食品藥品監督管理總局關于藥品注冊審評審批若干政策的公告》。《公告》中將仿制藥的生物等效性試驗由審批制改為備案制,首先在仿制藥上進行臨床試驗審批提速的嘗試。
2018年7月27日,藥審中心發布2018第50號文件《國家藥品監督管理局關于調整藥物臨床試驗審評審批程序的公告》(以下簡稱50號文)。50號文正式說明:自受理繳費之日起60日內,未收到藥審中心否定或質疑意見的,申請人可以按照提交的方案開展臨床試驗。
不僅政策上跟進迅速,藥審中心在執行上也毫不含糊。2018年11月5日,CDE官網主頁熱點欄目中,增加了“臨床試驗默示許可公示”一欄,并在當日公布了8個獲默許的受理號。此時距50號文發布才剛剛過去了三個多月的時間。我國的臨床試驗申報程序正式進入默示許可時代。
默示許可從制度層面上大刀闊斧的砍掉了此前冗余的審批流程。藥審中心在收到申報資料后5日內完成形式審查。符合要求或按照規定補正后符合要求的,發出受理通知書。再加上受理后的60天許可,一項申請材料齊全的臨床試驗,從申報到開展臨床試驗只需要65天的時間,比此前的審批速度加快了一年半。自默示許可公示欄開啟后,已經有1040個臨床試驗以默示許可的方式通過審批。臨床實驗審批加速卓有成效。
2.上市審批加速:消化積壓批件,創建優先審評機制
2015年9月,等待審評審批的藥品注冊申請達到了近22000件的高峰。國務院的44號文在這時看準時機,拍到了不斷上升的曲線頂端。在政策推動下,國家食藥監也在年底發布了更具體的政策指向,要求對八大類藥品實現單獨排隊,加快審評審批。
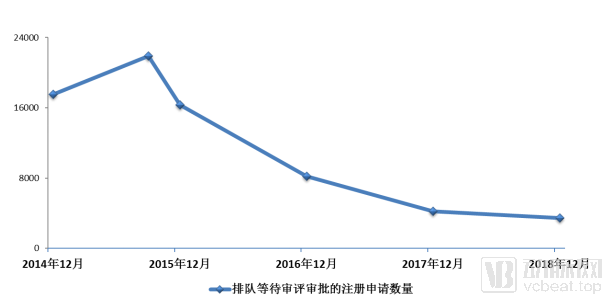
排隊等待審評審批的注冊申請數量變化情況
新政之下,藥審中心開始加速消化此前積壓的大量藥品申請,到2017年12月,待審數量已經從22000銳減到4000件,初步完成了44號文中國務院提出的工作目標。
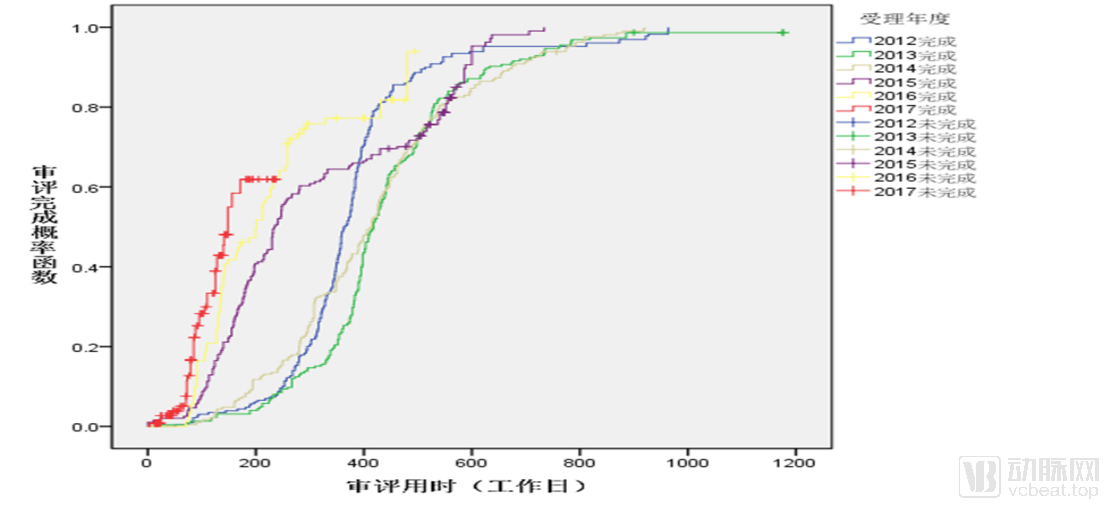
NDA審評用時逐年變化
同時,藥品審批的平均時長也得到了極大的壓縮。2017年的藥品NDA審評時長中位數已經縮短到了180天左右,而這一數字在2013年是400天以上。
2017年12月,CFDA發布《總局關于鼓勵藥品創新實行優先審評審批的意見》,在其中再次對整體藥品優先審評的落地方式進行了明確的說明,包括優先審評審批范圍、優先審評審批程序和工作要求等落地過程中的關鍵問題,并對審評流程進行了明確的時間規定,保證優先審評審批工作高效有序進行。
臨床試驗審批加速和藥品審評審批加速共同推動了藥品全流程審批加速,讓創新藥不再苦于緩慢的審評審批效率。這對于本就研發投入大,耗時長的創新藥行業來說,無疑是一針強心劑。加速審評還意味著創新藥企業可以更多的開展國際多中心試驗。以往因為國內審批緩慢造成的國內外時間差已經不復存在。
3.藥品上市許可持有人制度:明確責任主體,鼓勵技術創新
在2015年修訂的《藥品管理法》中,藥品注冊制度仍然是上市許可與生產許可相結合。也就是說,藥品批準文號只頒發給具有《藥品生產許可證》的生產企業。沒有生產能力的企業和機構從基本條件上就無法獲得藥品批準文號,技術創新無法與最終市場收益直接掛鉤,影響基礎研發者們的積極性。
于是在2016年的5月26日,國務院辦公廳發布《藥品上市許可持有人制度試點方案》。《方案》要求在10個省(市)開展藥品上市許可持有人制度試點,并對持有人的義務與責任、受托生產企業的義務與責任、及監管方式進行了全面的規定。
《方案》中提到,藥品上市許可持有人可以“委托藥品生產企業生產”,也可以“委托藥品經營企業經營”。上市許可持有人只需要在藥品的生產流通過程中進行監督,并保證藥品的可追溯就可以了。這一制度徹底打破了我國此前研產銷一體化的僵硬格局,讓各個環節上的企業可以進行自由組合,各盡其職,提升藥物創新效率。
藥品上市持有人制度是我國醫藥產業發展的關鍵制度邏輯。第一,基礎研發者們可以以持有人身份享有技術創新所帶來的最終市場收益,有利于鼓勵其積極研發;第二,明確了上市藥品造成人身損害后的責任承擔對象,促使持有人持續、主動關注上市藥品的安全有效性;第三,賦予了持有人委托生產的權力,引導盤活閑置生產線、減少重復投產,提高我國醫藥制造業的產能利用率。
藥品上市持有人制度的推行同時也催生了我國的CRO(合同定制研發)、CMO(合同定制生產)、CDMO(合同研發生產服務)等藥品產業鏈上的特化角色。在藥品生產流程中有專能的研發者可以在掌控核心競爭力的同時,借助CXO企業的力量進行研發、生產和藥品上市,自己作為藥品上市許可持有人最終獲益。
2017年6月1日,國際人用藥品注冊技術協調會(ICH)通過了CFDA的的申請,CFDA成為ICH正式成員。僅僅1年之后,在2018年第一次ICH會議中,國家藥監局又當選為ICH管理委員會成員。加入ICH,是國內醫藥行業發展的大勢所趨,是國內醫藥管理的重要拐點,同時也標志著國內的藥品管理體系獲得了國際范圍的認可。
加入ICH之后,國家引進進口原研藥的效率大幅提升。2018年藥審中心審評通過的新藥有106個,其中67個進口原研藥。
2018年7月6日,國家藥監局發布《接受藥品境外臨床試驗數據的技術指導原則》,允許將境外臨床試驗數據用于中國藥品注冊申請的資料。這一指導原則為后續的境外新藥引進打下了良好的政策基礎。
2018年10月,國家藥監局和衛健委發布《關于臨床急需境外新藥審評審批相關事宜的公告》。在國外企業主觀能動性差的情況下,國家藥監局選擇了主動出擊,邀請這些新特藥進入中國市場。
隨后CDE先后公布了兩批臨床急需的境外新藥,第一批40個,第二批26個。對于這些臨床急需的藥品,藥監局設立了專門通道開展審評,并且在審評過程中不需要在國內進行的臨床試驗資料,只提供境外取得的研究資料和不存在人種差異的支持性材料即可。藥審中心在時間上也做出了具體的承諾,在受理后6個月內完成技術審評。
加入ICH的好處已經逐步顯現。國內的各項標準都對標國際標準,臨床數據,生產標準與國際標準互通。國外的新特藥可以在臨床數據互認之后以更便捷的方式進入中國市場,而國內的新藥產品也將以國際標準獲批,有利于其走上國際化之路。
但是國內的醫藥行業同樣也不得不面對ICH標準對中國市場提出的挑戰。我國的醫藥產業長期以來存在著大量的低水平重復和創新不足的情況。加入ICH之后,中國的制藥產業不得不進入全球格局中參與競爭。藥監局先后邀請兩批境外新藥加速審批入境,也進一步加速了國內醫藥市場的國際化進程。而在國際范圍的競爭中,國內的創新藥企業只有以全球市場為目標,打造全球新的新藥產品,才有未來的出路。
在中國藥品市場逐步國際化的過程中,國產創新藥也不負國家的期望,逐漸在國際市場上嶄露頭角。早在2012年,我國的First in Class新藥本維莫德就與GSK達成交易,將其海外權益以最高2.3億美元授權給GSK。2015年9月,恒瑞醫藥卡瑞麗珠單抗的海外權益被美國Incyte公司以最高8億美金收入囊中。而就在這筆交易余溫尚未散去之時,信達生物又與跨國藥企禮來達成了三個腫瘤免疫治療雙抗藥物的全球開發合作協議,里程碑付款總金額超過10億美元。
在中國創新藥的出海路上,美國FDA已經表現出了接納的態度。FDA腫瘤學卓越中心主任Richard Pazdur在參加美國癌癥研究協會年會(AACR)時表示,只要臨床數據的質量足夠好,FDA愿意接受僅基于中國臨床數據的上市申請。并且FDA歡迎成本較低的PD-1/PD-L1抑制劑進在美國上市。
而國外的媒體和咨詢行業也已經開始關注中國迅速增長的創新藥產業,甚至已經出現了Chinabio today這樣專注于中國生物醫藥市場的媒體平臺。全球知名的咨詢公司麥肯錫正在密切關注中國的生物制藥行業,并發表對中國生物制藥產業的洞察,認為中國的生物制藥產業已經準備好變革。英國的經濟學報則發表了題為《中國醫藥行業正在成長》的文章,文中以百濟神州為例,稱中國的醫藥行業為冉冉升起的新星。
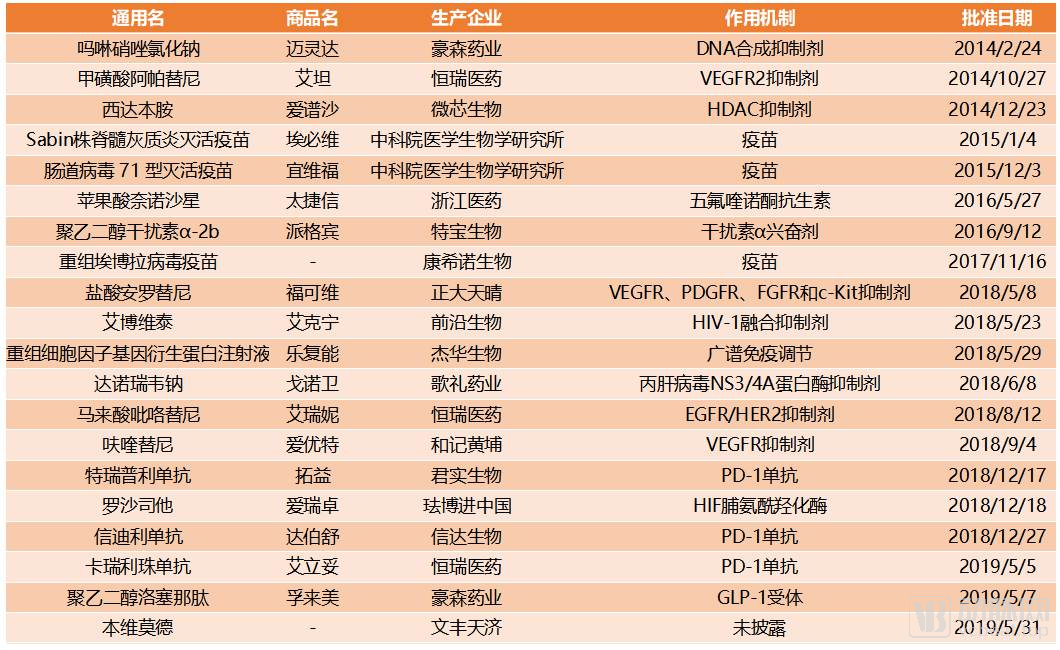
2014年以來藥監局批準的國產1類創新藥
過去的五年是中國創新藥產業加速發展的五年。尤其在2018年,CDE共批準了9款國產創新藥進入市場,創歷史新高。國家的政策在這些新藥的獲批中起到了輔助作用,但是更重要的還是堅持創新研發的中國創新藥企業。這些國內企業已經形成了國際醫藥行業的一股新勢力,讓中國的創新藥產業從跟跑到并行,未來還將繼續發力,沖入領軍行列。
1. 君實生物、信達生物:國產PD-1雙雄
2018年6月15日,CFDA批準百時美施貴寶的歐狄沃(納武利尤單抗)上市,成為國內首個獲批上市的PD-1單抗。一個月之后,7月25日,CFDA又批準默沙東的可瑞達(帕博利珠單抗)上市,腫瘤免疫治療正式進入國內臨床。
歐狄沃和可瑞達在國內上市之后,整體價格比國外市場有所降低。非小細胞肺癌患者使用歐狄沃的治療費用約為36萬/年,黑色素瘤患者使用可瑞達約為19萬/年。但是這樣的價格對于國內患者的經濟能力而言,仍然壓力較大。于是物美價廉的國產PD-1單抗就成了患者們翹首以盼的產品。
藥監局沒讓患者等太久。2018年12月17日,君實生物的拓益(特瑞普利單抗)上市,成為第一個獲批上市的國產PD-1單抗。緊接著在10天之后,信達生物的達伯舒(信迪利單抗)也獲批上市,腫瘤免疫治療國產時代正式開啟。按照贈藥計劃,惡性黑色素瘤患者使用拓益的治療費用只需93600元/年,還不到可瑞達價格的一半。非霍奇金淋巴瘤患者使用達伯舒的治療費用也只需要17萬/年。
在2019年的年中報中,君實生物的拓益在2月底開售之后,共獲得了3.03億元的總銷售額;信達生物3月中旬開售的達伯舒更是在三個多月的時間內賣出了3.32億元。在國內不斷增長的PD-1市場中,國產PD-1已經逐漸具備了與進口產品分庭抗禮的能力。如今恒瑞醫藥的PD-1單抗艾瑞卡(卡瑞利珠單抗)也加入戰局,針對適應癥和聯合用藥的PD-1下半場已經開始。我們也希望看到國產的PD-1單抗能在未來的發展中帶給我們更多的驚喜。
2.恒瑞醫藥:專注創新藥的中國巨頭
說到恒瑞醫藥,很多人想到的是以腫瘤藥、麻醉藥品、造影劑、特色輸液為主要產品的傳統國內藥企巨頭。但其實,恒瑞醫藥從誕生的哪天起,骨子里就刻上了創新的基因。
艾瑞昔布是一款2011年獲批的國家一類新藥,用于緩解骨關節炎的疼痛癥狀。恒瑞醫藥早在1999年就開始了相關的研究,2002年進入臨床一期,被科技部列入國家“863 計劃。雖然隨后的銷售情況一般,但是艾瑞昔布對恒瑞醫藥來說,其代表意義遠大于實際的經濟價值。艾瑞昔布的獲批代表著恒瑞醫藥作為創新藥企業的研發能力。
2014年11月,甲磺酸阿帕替尼片獲批上市,正式將恒瑞醫藥的研發能力推到了國際水平上。阿帕替尼是全球第一個在晚期胃癌被證實安全有效的小分子抗血管生成靶向藥物,也是晚期胃癌標準化治療失敗后,療效最好的單藥。當年6月,該藥的臨床研究被美國臨床腫瘤學會(ASCO)選作大會報告,這也是中國創新藥研究第一次在全球頂級學術會議上作大會報告,第一次入選該年會優秀研究。
恒瑞醫藥的2018年年報中顯示,阿帕替尼的年銷量達到了17.41億元,是恒瑞醫藥銷量最高的產品,占其總營收的10%。同時恒瑞醫藥還在積極布局阿帕替尼的適應癥拓展,在肺癌、乳腺癌、聯合免疫療法等方面都成功的找到了自己的定位,并正在積極推進臨床研究。
在阿帕替尼之后,恒瑞醫藥又有馬來酸吡咯替尼和卡瑞利珠單抗相繼上市。前者是用于乳腺癌的1.1類新藥,后者則是第三款獲批的國產PD-1單抗。除了已上市的產品之外,恒瑞醫藥的研發管線中,已經進入臨床階段的還有接近30種產品。“中國醫藥第一股”正在創新研發的海洋上乘風破浪。
3.貝達藥業:開啟國產EGFR靶向藥時代
2010年,進口靶向藥阿斯利康EGFR激酶抑制劑(TKI)吉非替尼(易瑞沙)在國內上市,但是極其昂貴的價格讓大多數患者望而卻步。
貝達藥業的鹽酸埃克替尼,是我國自主研發的首個小分子靶向抗癌藥。埃克替尼的Ⅲ期臨床試驗ICOGEN是全球第一個激酶抑制劑互為對照的注冊Ⅲ期臨床試驗,對照藥正是阿斯利康的吉非替尼。
當時幾乎全國最好的腫瘤醫院都參與了這一試驗,PI(主要研究者)由中國醫學科學院腫瘤醫院孫燕院士擔任,Co-PI(合作研究者)由中山大學附屬腫瘤醫院張力教授擔任,醫科院腫瘤醫院石遠凱教授任專家委員會主任委員。全國包括北京、上海、廣州、南京、杭州、長沙、西安、重慶、長春等9個城市27家醫院參與多中心試驗。試驗總入組晚期非小細胞肺癌患者400人,歷經10個月后在2009年11月13日完成,剔除一例不合格患者后入組總人數399人。埃克替尼組200人,吉非替尼組199人。
2010年5月,ICOGEN試驗的開盲結果在杭州進行,這是一個令貝達研發團隊和臨床試驗機構異常緊張的時刻。一旦結果不理想,不僅意味著貝達藥業近十年的研究心血付諸東流,也意味著投資人、企業、國家的巨大投資打了水漂。
令人興奮的是,最后的開盲結果顯示,埃克替尼具有很好的臨床效果,二、三線治療晚期非小細胞肺癌患者療效和吉非替尼相當,不良反應更少。無進展生存期(PFS)埃克替尼為4.6月,吉非替尼為3.4月,沒有顯著的統計學差異。總不良事件統計為60.5%,吉非替尼為70.4%,埃克替尼的安全性更好、患者耐受度更佳。
埃克替尼的上市創造了幾個第一:全球第一個激酶抑制劑(TKI)互為對照的注冊Ⅲ期臨床試驗;亞洲第一個激酶抑制劑(TKI)靶向抗癌藥;中國第一個有自主知識產權的小分子抗癌藥;在中國第一次采用進口專利藥做頭對頭雙盲對照的Ⅲ期臨床試驗。埃克替尼在中國以及全世界腫瘤界獲得非常大的關注,不僅在療效上做到了Me-too,還在不良反應上做到了Me-better。而貝達藥業也借此躋身國內創新藥研發前列,成為國產創新藥的一股新勢力。
4.天士力生物:國產三代溶栓藥締造者
天士力生物出品的普佑克是全球唯一上市的CHO細胞表達的尿激酶原產品,通過基因工程方法構建的中國倉鼠卵巢細胞(CHO細胞)表達獲得,用于治療急性ST段抬高性心肌梗死的溶栓治療,屬于第三代溶栓制劑。主要通過激活纖維蛋白表面的纖溶酶原而發揮選擇性溶栓作用,目前已進入多個心血管疾病臨床用藥指南。
目前市場中溶栓治療的主流藥物為阿替普酶和尿激酶,主要在不具備PCI手術條件的醫院中使用。普佑克作為三代溶栓藥的代表,具備纖維蛋白特異性并且無抗原和過敏反應,IV期臨床2088例數據結果表明,該藥對急性心肌梗死病人血管開通率達到85.2%,藥物相關的顱內出血發生率僅為0.19%,而且半衰期達到114分鐘,綜合性價比高。
2017年,普佑克通過人社部價格談判,降價11.5%,進入國家醫保目錄,醫保支付價為1020元/支。2016年普佑克銷售額為0.38億人民幣,2017年銷售額為0.99億,增長迅猛。普佑克進入醫保后,成為溶栓主導產品,刺激2018年銷售額繼續大幅度增長。2018年普佑克銷量突破2.2億元,相比2017年增長129.58%。
天士力生物在今年6月向港交所遞交了上市申請,14條研發管線主要集中在心腦血管疾病、腫瘤領域和消化代謝領域。在研的管線中,普佑克的缺血性腦卒中適應癥Ⅲ期臨床進展順利,急性肺栓塞適應癥也已經進入Ⅱ期臨床階段。未來的天士力生物仍有更多值得期待的新發展。
5.微芯生物:科創板上市二次爆紅
2019年7月17日上午,有媒體發布報道,微芯生物或將“被撤回”。然而當天下午,證監會就公布了微芯生物獲批上市的消息,謠言不攻自破。微芯生物登陸科創板的發行價20.43元/股。到了8月12日上市的那天,開盤股價就暴漲至125元/股,較發行價上漲512%。這樣的大起大落把微芯生物瞬間推上了風口浪尖。
微芯生物的西達本胺其實早在2014年就已經獲批上市,用于治療外周T細胞淋巴瘤。但是由于獲批的適應癥范圍太小,一直沒有掀起關注熱潮。西達本胺是一種HDAC抑制劑,目前全球全球僅3家企業在生產同類藥物,其中兩家在美國,每月治療費用分別為28萬元人民幣和14萬元人民幣。而相比之下,西達本胺每月費用為2萬多元人民幣,價格只相當于國外費用的十分之一。
微芯生物始終在推進西達本胺的進一步研究,嘗試拓展西達本胺的適應癥范圍,并且已經取得了一定的成效。西達本胺的乳腺癌適應癥已經申報,并被列入優先審評審批。有關非小細胞肺癌和彌漫性大B細胞淋巴瘤的臨床試驗也在穩步擴展中。
除此之外,微芯生物還有西格列他鈉、西奧羅尼等7款產品在研。在科創板上市募集的資金大多都用于進一步推進相關產品的研發進程。未來微芯生物也會持續創新,以拯救健康為己任。致力于為患者提供安全、優效、可承受的創新機制的治療藥物。
6.琺博進中國:羅沙司它成為首個全球研發中國首發的1.1類新藥
2018年12月18日,羅沙司他在中國率先獲批上市,用于治療正在接受透析治療的患者因慢性腎臟病(CKD)引起的貧血。2019年8月20日,羅沙司他在中國收獲全球第二個適應癥,將非透析的慢性腎性貧血(NDD-CKD)也納入其適應癥范圍。羅沙司他在中國率先上市,標志著我國首次在First in Class新藥上走到世界前列。
羅沙司他的臨床前研究主要在國外完成,但是其研發廠商琺博進早在2010年就在國內開啟了Ⅰ期臨床試驗,并在2011年成立了琺博進中國,并在中國建廠生產相應的藥品。2017年底,羅沙司他被列入優先審評。
2019年7月25日,《新英格蘭醫學雜志》(NEJM)背靠背在線發表兩篇關于腎性貧血創新藥羅沙司他的研究論著,公布其在中國的兩項 III 期臨床試驗結果;并配發國際知名腎病專家述評。這是 NEJM 首次發表由中國內地醫生作為第一和通訊作者的新藥 III 期臨床試驗,也是該雜志首次背靠背發表中國團隊的臨床試驗。
在慢性腎病(CKD)4-5期患者中有超過50%的人有貧血癥狀,透析患者中更有60-90%的患者患有不同程度的貧血。長期以來,臨床上一直用“促紅素”+“補鐵劑”的組合拳來管理慢性腎病患者的貧血問題,但收效一般。羅沙司他通過單一口服藥就可以解決這一臨床難題,將有機會革新慢性腎病貧血的治療方式。
7.文豐天濟:中國第一個“全球新”的皮膚科新藥
2019年5月31日,本維莫德獲批上市,用于局部治療成人輕至中度穩定性尋常型銀屑病。這款我國自主研發的First in Class皮膚科新藥在經過了20年的長征之后,終于結出了一顆重磅果實。
銀屑病常用的外用治療主要為糖皮質激素和維生素D3衍生物,但是激素類藥物有易反復和副作用的問題。所以以卡泊三醇為代表的維生素D3藥物已經成為治療銀屑病的一線用藥,是非激素外用藥物的“金標準”。
本維莫德的Ⅲ期臨床試驗結果表明,本維莫德與卡泊三醇相比,具有相同甚至更高的療效。本維莫德同樣具有起效快、作用持久、停藥后復發率低、安全性高等顯著優勢,并且未見系統性不良反應。也就是說,本維莫德很有可能可以取代卡泊三醇成為銀屑病治療中的“新標準”。
本維莫德從8月26日的首單之后,市場反饋非常積極。盡管496元1支的價格略顯昂貴,但是整體銷售仍然處于供不應求的情況中。本維莫德目前主要的銷售方式是通過醫院醫生處方,患者前往DTP藥房進行購藥。文豐天濟未來也會擴大完善銷售隊伍,讓更多的患者盡早用上中國制造的全球新藥。
8.康希諾生物:國產疫苗之光
康希諾生物的埃博拉疫苗Ad5-EBOV于2017年10月獲得NMPA新藥申請批準,可作為應急使用及國家儲備。與跨國企業的競爭產品相比,該產品展示出更佳的穩定性且不需要超低溫儲存條件。
康希諾生物的埃博拉疫苗采用了國際先進的復制缺陷型病毒載體技術和無血清高密度懸浮培養技術,可同時激發人體細胞免疫和體液免疫,在保證安全性的同時,還具備良好的免疫原性。此外,該疫苗還突破了病毒載體疫苗凍干制劑的技術瓶頸。特別是在非洲等高溫地區進行運輸和使用時,具備更加突出的優勢。
除了埃博拉疫苗之外,康希諾生物還立足于五大核心技術平臺,發展了14條在研產品管線,覆蓋包括肺炎、結核病、埃博拉病毒病、腦膜炎、百白破、宮頸癌等一系列疾病。
3月28日,康希諾在香港聯交所主板正式上市。這起IPO,意味著康希諾生物作為“港股第一疫苗股”正式登陸資本市場。在國產疫苗行業問題頻發的局面下,康希諾生物無疑是國產疫苗行業的一盞明燈,為中國疫苗行業書寫新的篇章。
本文為本網轉載,出于傳遞更多信息之目的,并不意味著贊同其觀點或證實其內容的真實性,如涉及侵權,請權利人與本站聯系,本站經核實后予以修改或刪除。
請完善以下信息,我們的顧問會在1個工作日內與您聯系,為您安排產品定制服務
評論